正在处理图像?您可以使用最新版本的 FlowJo v10(10.0.7 或更高版本)打开、门控并向图像文件添加统计信息。
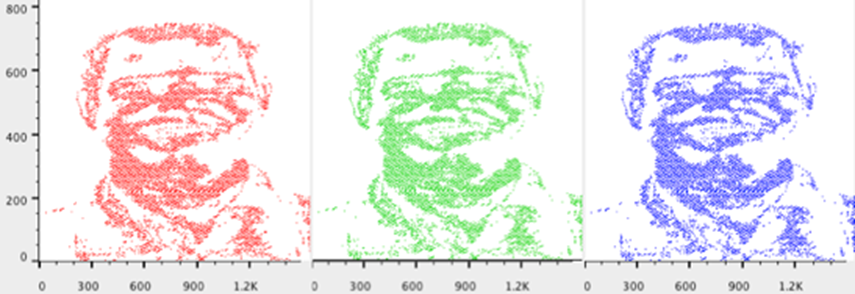
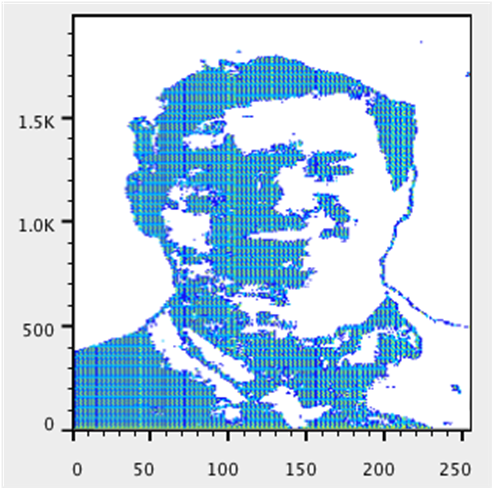
图像文件(如FCS文件)可以解析为组成部分进行分析。与 FCS 文件中的事件或细胞类似,像素通过其颜色和亮度属性来表征。在这种情况下,像素被视为事件;可以在感兴趣的区域(例如 GFP+ 区域)上创建门控,可以添加 MFI(中位荧光强度)和其他统计数据,并且可以通过表格和布局编辑器生成报告以显示样本或实验的结果。
除了分析单个图像文件之外,FlowJo v10 的图像分析功能还可以应用于元分析。也就是说,根据特定特征对图像进行分组(例如,具有特定标签、抗原或蛋白质高表达的图像)。这对于高通量应用或当您有来自实验的多个图像并且需要快速确定哪些文件包含图像并且像素色调或饱和度高于指定阈值时特别有用。
接受的图像文件类型
目前,FlowJo v10 可以打开 JPEG、PNG、BMP 和 GIF 图像。许多实验室仪器会将图像数据保存为专有文件类型或 TIFF。必须先将 TIFF、PDF 和其他图像文件类型转换为可接受的格式,然后才能在 FlowJo工作区中打开它们。幸运的是,有大量图像软件可用于转换几乎任何文件类型(例如 ImageJ、Adobe Photoshop、Macintosh 的预览应用程序等)。
打开图像文件。
以下步骤将指导您在 FlowJo v10 中打开图像文件。
1.在 FlowJo v10(10.0.7 或更高版本)中打开一个新的工作区。
2. 打开 Finder 或 Explorer 窗口来查找感兴趣的图像文件。
3. 选择图像文件(JPEG、GIF、BMP 或 PNG)并将其拖到工作区。
4. FlowJo 会将图像文件转换为FCS文件,并应出现在 Finder/Explorer 窗口以及工作区中。根据图像的大小和系统的功率,可能需要几秒钟才能出现。
5. 双击图像开始分析图像。注意:对于较大的图像,您可能需要将图像导出为 FCS3 文件,并将“事件”数量减少一个或两个数量级。有关导出文件的更多信息,请单击此处。
图像文件内容
为了在 FlowJo 中打开图像,首先必须将其转换为 FCS 文件。FlowJo 包含一个“文本到 FCS”库,可以将各种文件类型转换为 FCS 文件。然后,新生的 FCS 文件将出现在工作区中。创建后,可以将其拖入工作区并以与任何其他 FCS 文件相同的方式查看。但需要注意的是,必须将图像文件和新合成的 FCS 文件从 Finder/Explorer 窗口拖入工作区。使用打开命令不会允许将图像转换为 FCS,也不会打开生成的 FCS 文件。有关如何在 FlowJo 中打开图像文件的详细说明,请参阅上面的部分。
FlowJo 将图像文件转换为包含 32 个关键字的 FCS 文件,其中 16 个是参数 (8) 及其相关的染色名称 (8)。此外,FlowJo 将图像轴逆时针旋转 90°。有关 FCS 文件中包含的关键字的详细描述,请单击此处。本节的大部分内容将专门讨论参数(和相关染色)名称。

合成的FCS文件中包含的8个参数涵盖像素的一组值;它在笛卡尔网格上的位置以及它在RGB立方体和色轮(或更准确地说,三维色锥)上表达的值。
位置参数。
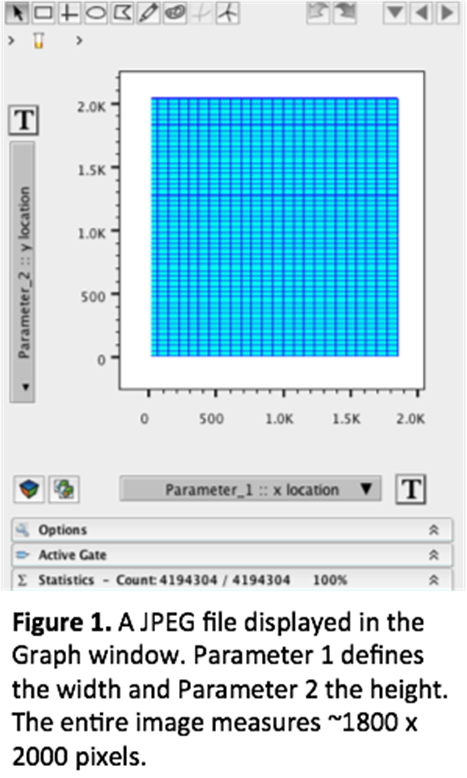
前两个参数基本上定义了图像的大小。通过同时查看这两个参数,您可以将图像描述为“X”像素宽、“Y”像素高。在下面的例子中,图像大约为 1800 像素宽 x 2000 像素高(见图 1)。有时您可能需要调整比例以使整个图像适合图形窗口。只需按“T”按钮并添加一些正和/或负十进制。如果您正在处理相同大小的图像,您可能需要考虑保存图像缩放比例以供您要引入的其他文件使用,这样您就不必每次都重新缩放它们。
颜色参数
参数 3-5 定义每个颜色通道(红色、绿色、蓝色 - RGB)的像素强度。这些可以被认为是测量指定颜色绝对强度的参数。RGB 参数相当简单,可用于回答基本问题,例如“这个像素有多少蓝色?”或“哪些像素包含 X 量的蓝色?”
参数 6-8 明显不太直观,对应于六角锥色柱 (HSV) 的尺寸。此模型将三维色锥分解为三个不同的维度,分别对应于色调、饱和度和值。

色调
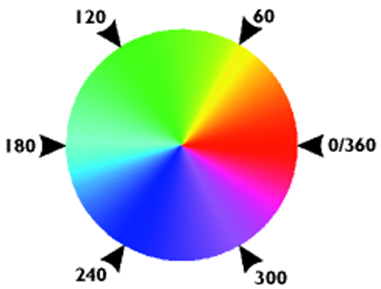
还记得首字母缩略词 ROY-G-BIV 吗?可见光谱通常以线性刻度表示,从低能量到高能量,颜色依次为红色、橙色、黄色、绿色、蓝色、靛蓝和紫色。色调参数 (6) 将此线性刻度包裹成一个圆圈。此参数的刻度以度 (°) 表示。0-45° 代表红色,45-90° 代表橙色和黄色,90-170° 代表绿色,170-190° 代表青色(红色的补色),190-260° 代表蓝色,260-350° 代表靛蓝和紫色,最后 350-360° 代表红色。
饱和度和价值
饱和度和值(分别是参数 7 和 8)是不太直观且有争议的色彩特性描述符。饱和度定义添加到特定颜色以获得输出的白色或暗度的程度。饱和度的 HSV 模型值介于 0 和 1 之间。接近 1 的值往往是黑色,接近 0 的值则为白色。出于实际的图像分析目的,我们将剔除接近零和一的值。最后,值参数包含有关指定像素保留了多少特定颜色的信息。与饱和度类似,值参数缩放为 0 到 1 之间的数字。接近 1 的值更亮,代表所谓的“纯色”。有关 HSV 颜色模型和数字色彩的更多信息,请单击此处。
图像分析
可视化图像
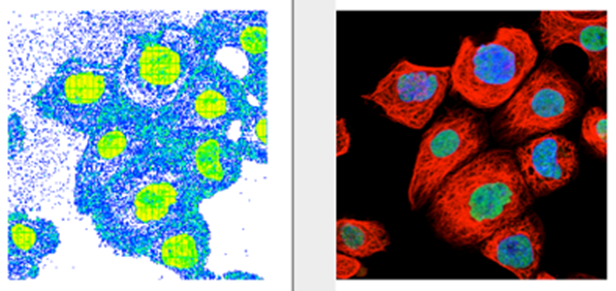
对于我们的第一个练习,我们将在 FlowJo 中打开一个图像,并在图形窗口中重建它,使其看起来与我们的实际图像相似。本练习的目的是为进一步分析创建一个参考点。本节假设用户熟悉打开工作区、拖放、门控和基本重新缩放功能。如果您需要任何帮助,请单击单词或主题内的链接。
1. 首先从 Finder/Explorer 窗口或桌面拖动图像。
2.将新合成的FCS文件(与原始文件同名,但带有FCS扩展名)拖入工作区。
3. 双击FCS文件打开图形窗口。
4. 重新调整 X 和 Y 位置参数(参数 1 和 2),以使图像恰好位于图形窗口内。
5. 将 X 轴上的参数更改为饱和度(参数 7)。

6. 将 Y 轴上的参数更改为直方图。
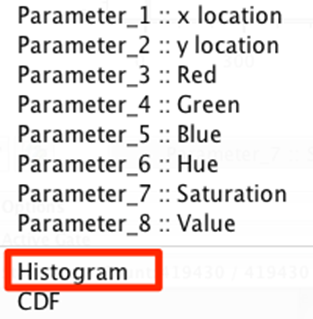
7.

如有必要,重新调整饱和度参数。
8. 在饱和度参数上创建一个范围门,排除靠近左轴或右轴的值。这将消除全黑或全白的像素。
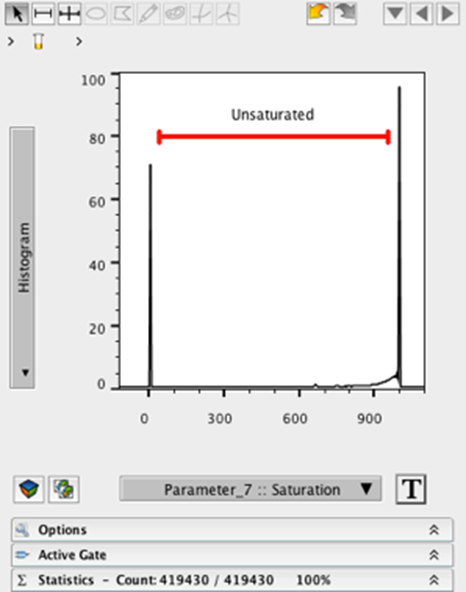
9. 将此门命名为 Unsaturate。
10. 双击门来查看儿童人口。
11.将X轴和Y轴分别改为参数1和2。
12. 您应该在图形窗口中看到与实际图片大致相似的“图像”。注意:FlowJo 将轴逆时针旋转 90°。为了进行直接比较,请指示您的照片编辑程序将图像向左旋转 90°。
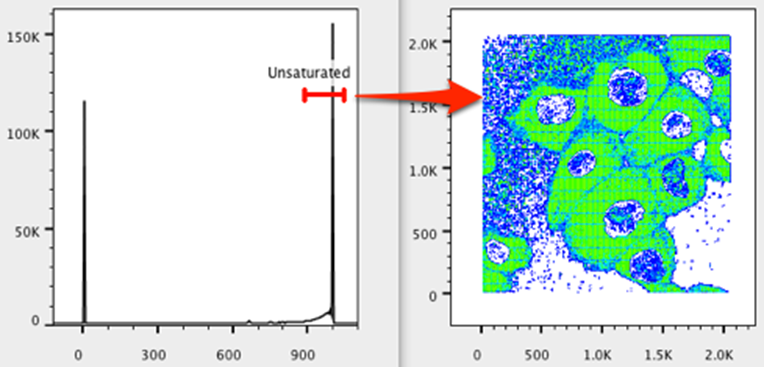
13. 将不饱和门向右移动,并调整其大小以仅包含饱和事件。请注意,图中包括大多数像素颜色丰富的区域(在我们的例子中是细胞质和细胞核)。
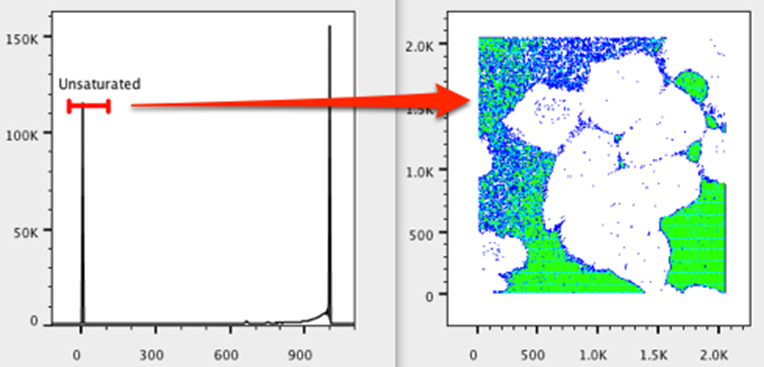
14. 将不饱和门向左移动,并调整其大小以包含饱和度最低的事件。请注意看起来像是摄影“负片”的东西。饱和轴上接近零的事件表示像素包含的颜色最少的区域。在我们的例子中,这些是没有细胞的区域。
图像重建 RGB
荧光/多通道显微镜的常见做法是将图像可视化为单通道产生的图像。通过查看各个通道,我们可以确定特定生物分子是否存在,评估其强度、几何形状和细胞内的位置。
在下一个练习中,我们将逐通道重建图像,并使用布局编辑器创建覆盖图(合并图)。
将图像文件拖拽到工作区。将图像关联的 FCS 文件拖拽到工作区中。双击FCS文件即可在图形窗口中打开图像。调整 X 和 Y 位置参数(1 和 2)的大小,使图像适合图形窗口。有关详细信息,请参阅上文。将 X 轴更改为参数 3(红色)。将 Y 轴更改为直方图在直方图上创建一个范围较宽的门,排除接近 0 的事件。
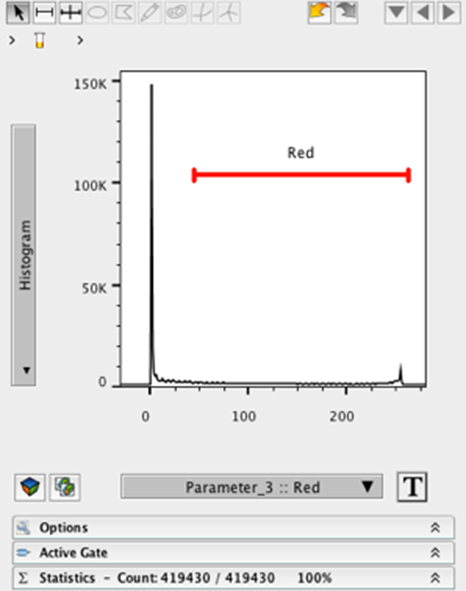
8. 给门命名(例如红色)
9. 双击门来打开儿童人口的图形窗口。
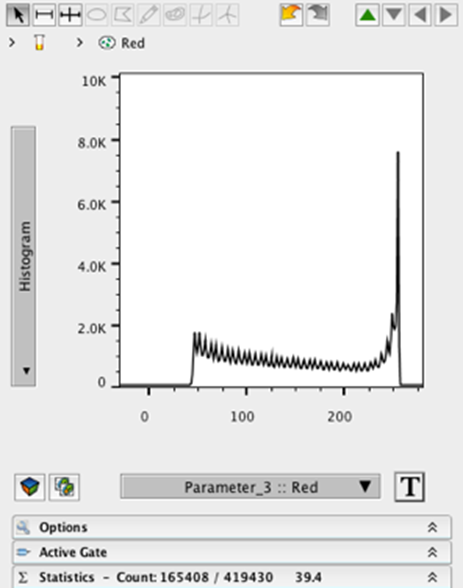
10. 将 X 轴更改为参数 1。
11. 将 Y 轴更改为参数 2。
12. 您应该看到一个绘图,其呈现的图案与仅在红色通道中显示的图像文件类似。
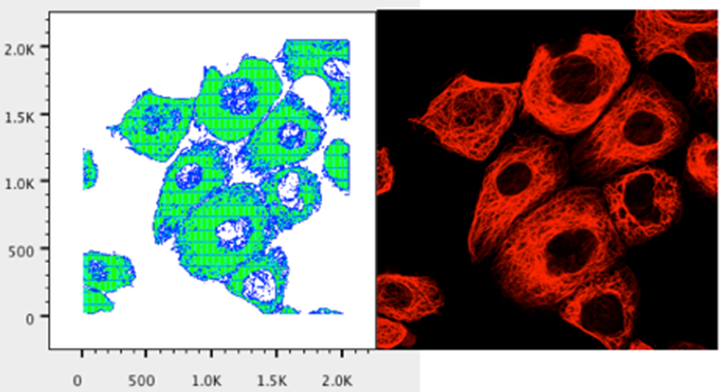
13. 使用左下角的复制图形窗口图标复制图形窗口。
14. 在复制的图形窗口中,单击绿色“向上”箭头返回亲本群体。
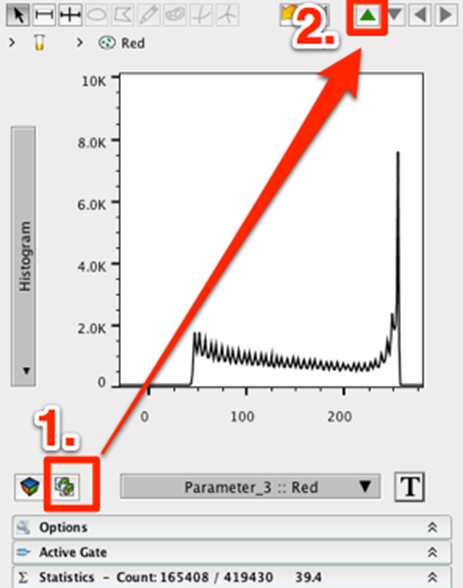
15. 将 X 轴改为绿色。
16. 将 Y 轴更改为直方图。
17. 在直方图上创建一个宽范围的门,排除接近 0 的事件。
18. 给门命名(例如绿色)。
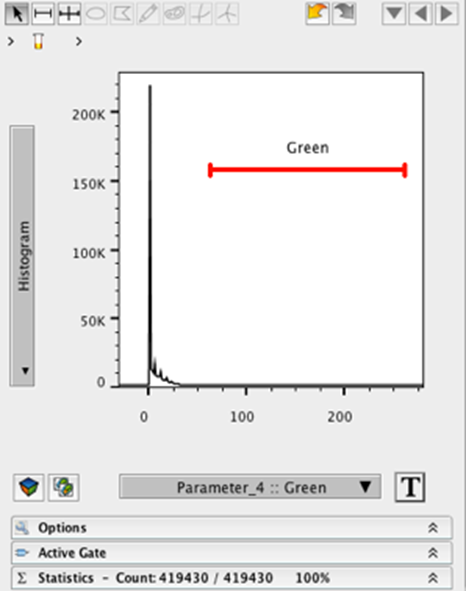
19. 重复步骤 9-12,以可视化代表图像中绿色通道的图。

20. 对蓝色通道重复步骤 13-18。
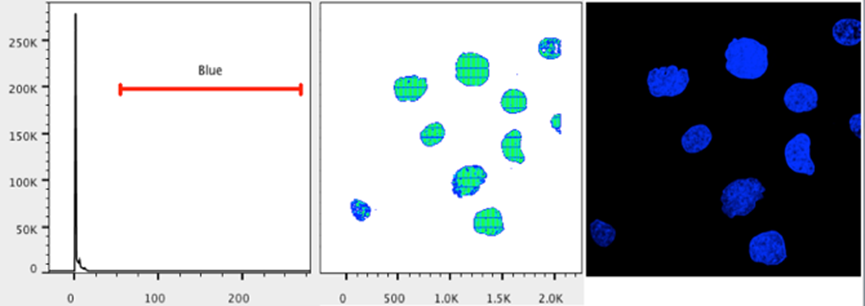
21. 打开布局编辑器
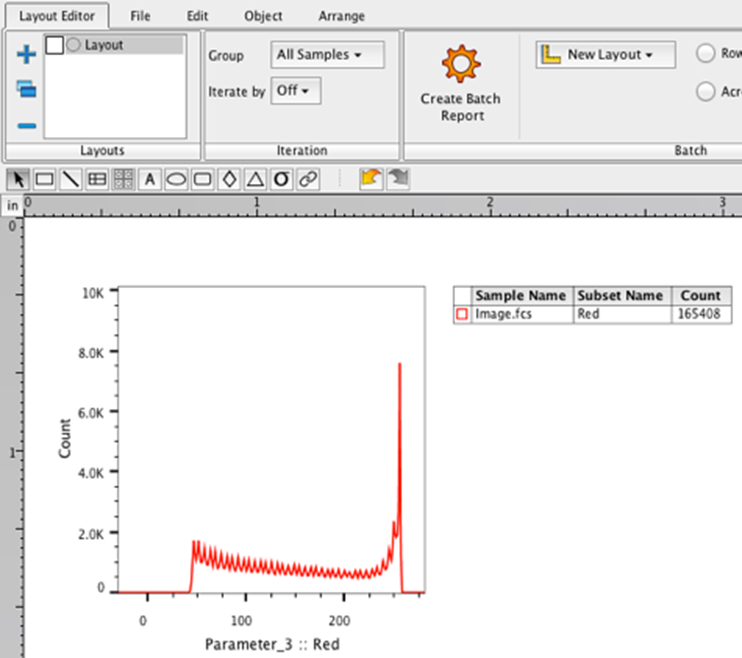
22. 在工作区中选择红色群体。
23. 将红色种群拖入布局编辑器。应出现红色种群的直方图。
24. 按住 Control/command 键并单击以选择工作区中的绿色和蓝色群体。
25. 将绿色和蓝色群体拖到布局编辑器中的红色图上。
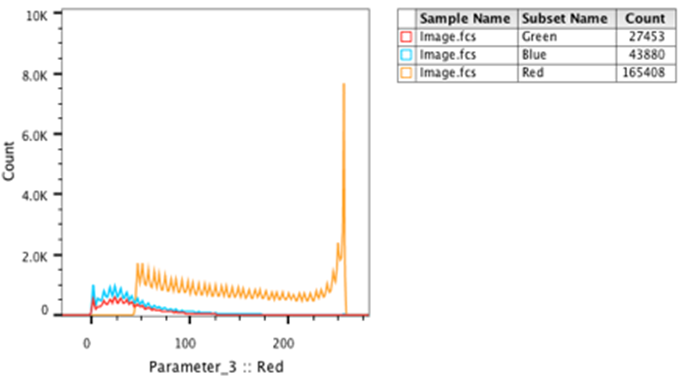
26.将创建一个代表所有三个通道的覆盖图。
27. 双击图形打开图形定义窗口。
28. 在指定选项卡上,将图形类型更改为点图。
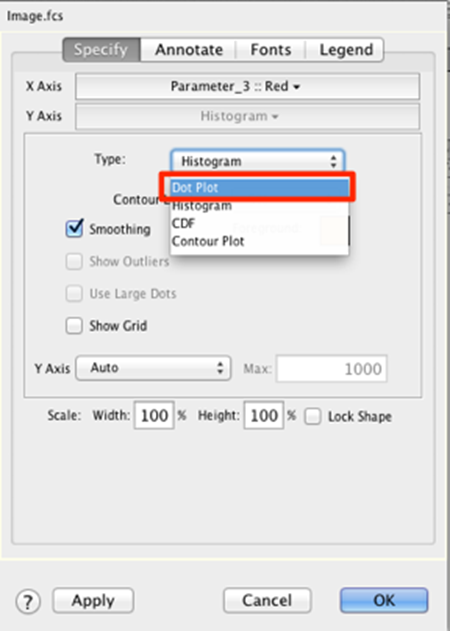
29. 将 X 轴和 Y 轴分别更改为参数 1 和 2。
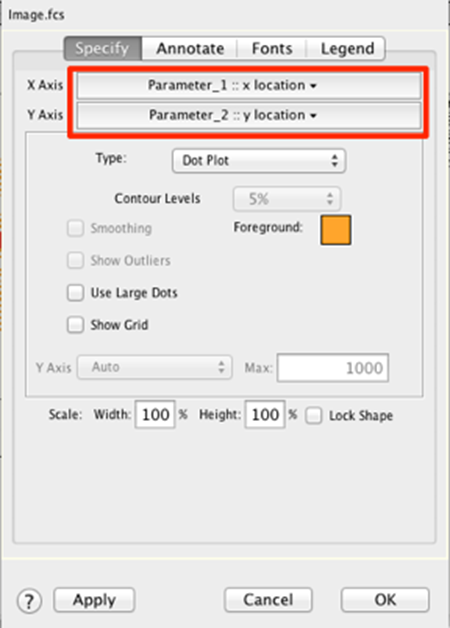
30. 单击“应用”,然后单击图形定义窗口底部的“确定”以应用您的更改。
31. 通过选择图例并滚动调色板来更改点图的颜色。
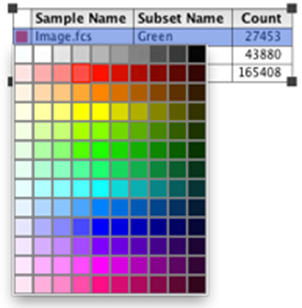
32. 将点图的颜色更改为适当的通道颜色,以在 FlowJo 中重建图像。
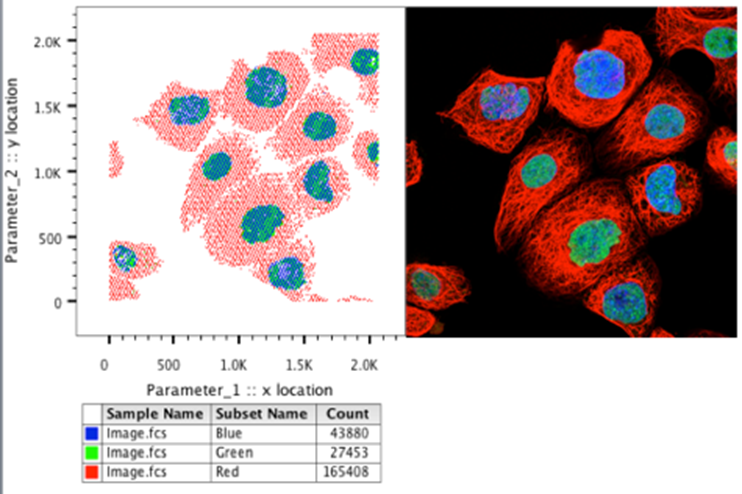
像素分析 RGB
荧光显微镜是一种广泛使用的技术,通常使用 3 个紫外线光源。这些光源产生了我们在整个科学文献中看到的流行的红色 (R)、绿色 (G) 和蓝色 (B) 合并图像。虽然系统不限于这三个通道(颜色),但这些参数仍然是最广泛使用的。下一节将重点介绍使用这三个通道进行分析的图像。如果您的图像除了 RGB 之外还有通道,您可能希望查阅以下有关 HSV 图像分析的部分。
测量特定通道的像素强度通常很有用,可以作为比较的一种方式。例如,您可能有从对照样本中获取的图像,并希望将其与一组实验图像进行比较,以辨别表达的定性/半定量水平、分子的存在与否,或某些生物实体的几何形状。
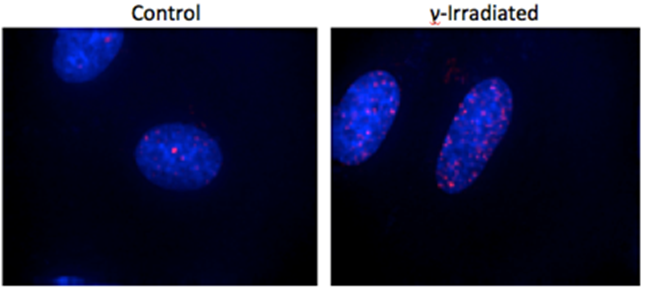
在下面的练习中,我们将量化对照和辐照大鼠胚胎成纤维细胞细胞核中磷酸化 γ-H2AX 的表达。γ-H2AX 是一种组蛋白,它被磷酸化并被募集到 DNA 双链断裂位点。γ 辐射会导致 DNA 双链断裂,从而增加细胞核中磷酸化 γ-H2AX 的存在。
本练习假设用户知道如何打开工作区、添加样本、重新缩放轴、创建门和统计数据以及如何一般地使用布局和表格编辑器。
打开一个新的工作区。
将您想要分析的图像文件从 Finder/Explorer 窗口拖放到工作区中。
首先从控制图像开始分析。通过调整参数 1 和 2(x 和 y 位置)来调整图像大小。
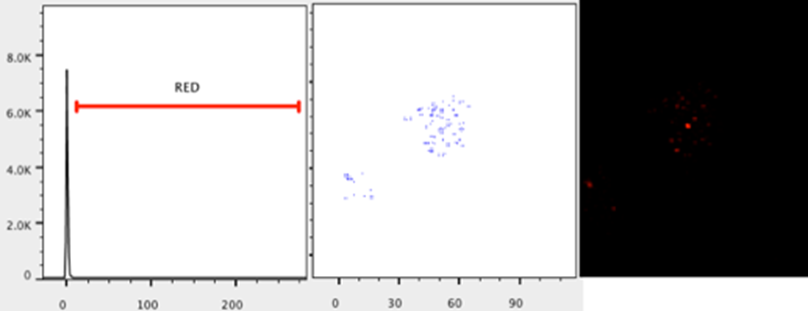
将 X 轴更改为参数 3(或表达感兴趣分子的通道)。
将 Y 轴更改为直方图。创建一个范围门,排除接近零的值。
命名远程门(例如红色)
通过查看儿童群体并将轴更改为位置参数(参数 1 和 2),检查距离门是否包含图像中存在的像素。如有必要,调整距离门。
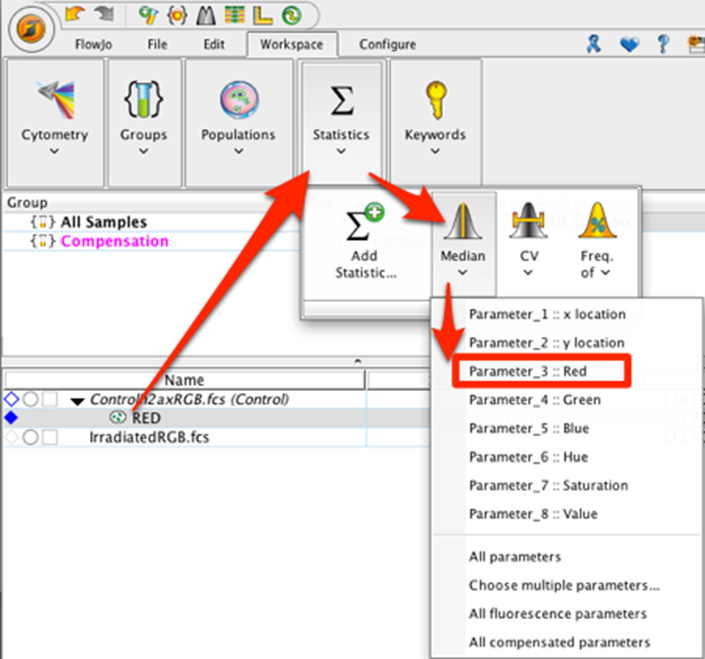
10. 在工作区中为红色人口添加中位数统计数据。
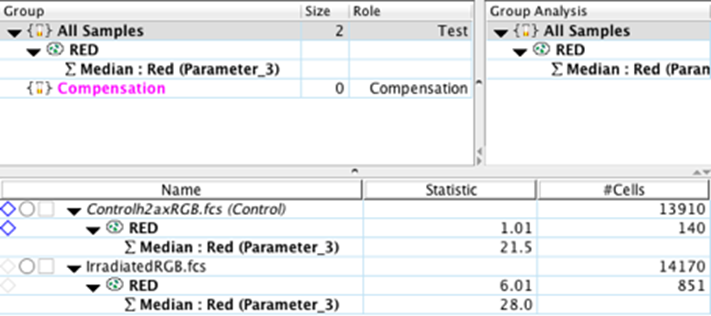
11. 将分析复制到组(红门和中位数统计)。
12. (可选)作为内部控制,使用另一个通道,其中抗原表达预计不会因治疗而显着增加/减少,并按照步骤 5-11 添加统计数据和门(例如用于 Hoescht 染色的蓝色通道)。
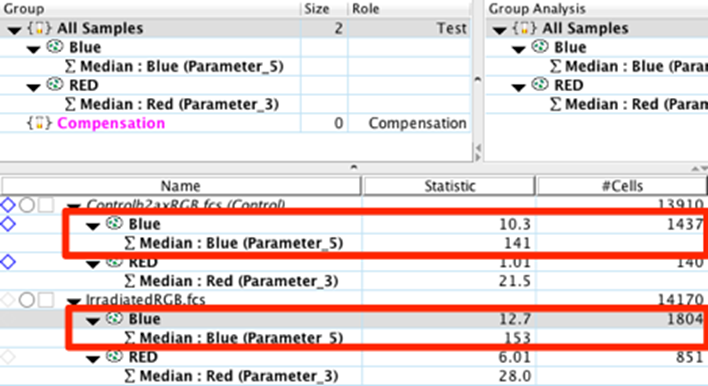
13. 您可以使用表格和布局编辑器导出这些统计数据并生成图形报告。有关创建表格和图形报告的更多信息,请单击本句中的表格或布局编辑器链接。
从工作区计算出的统计数据中,我们可以立即看到对照样品和实验样品之间的显著差异。辐照样品中磷酸化 γ-H2AX 蛋白的 MFI 增加了 30%。此外,落入红门的事件数(在我们的例子中是像素)是对照样品中事件数的 4 倍以上。重要的是要记住将多张图像相互比较,以实现统计显著性并降低由其他因素(例如细胞大小、细胞数量、载玻片上的位置等)引入的变异性。
图像文件的元分析
即将推出,您将能够一次门控多张图像,并根据荧光强度、饱和度、像素数等对其进行分组。

